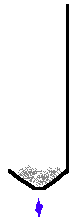1.2. Comment former une nouvelle substance?
Reprenons notre mélange fer-soufre. Nous allons maintenant nous livrer sur lui à diverses manipulations et en observer le résultat.
Expérience 1
|
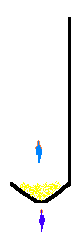
Fer Dans un tube à essais, introduisons un peu de limaille de fer. Ajoutons un peu d'acide chlorhydrique.
L'acide réagit avec le fer. Il se dégage un gaz explosif: le dihydrogène, incolore et inodore. |
Soufre Dans un tube à essais, introduisons un peu de fleur de soufre. Ajoutons un peu d'acide chlorhydrique.
L'acide ne réagit pas avec la fleur de soufre. |
Fer-soufre Dans un tube à essais, introduisons un peu de mélange fer-soufre. Ajoutons un peu d'acide chlorhydrique.
L'acide réagit avec le fer du mélange fer-soufre. Il se dégage un gaz explosif: le dihydrogène, incolore et inodore. |
Expérience 2
|
Fer Prélevons un peu de limaille de fer grâce à une cuiller à combustion. Chauffons énergiquement.
Nous obtenons une masse rouge. Après refroidissement, le fer a conservé ses propriétés caractéristiques initiales |
Soufre Prélevons un peu de fleur de soufre grâce à une cuiller à combustion. Chauffons énergiquement.
Le soufre devient liquide, ensuite il brûle avec une flamme bleue. Une odeur piquante se dégage. |
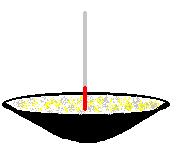
Fer-soufre Versons un peu de mélange fer-soufre dans un creuset. Introduisons dans le mélange une tige métallique portée au rouge.
Le mélange fer-soufre a changé d'aspect. Il ne montre plus de propriétés magnétiques. Le sulfure de carbone n'a aucun effet. |
Lors de la combustion du mélange fer-soufre, les propriétés caractéristiques initiales du fer et du soufre ont été perdues. Le solide gris est une nouvelle substance. Sous l'effet de la chaleur, le fer et le soufre ont formé du sulfure de fer. Nous écrirons:
|
Fer +
Soufre Chaleur |
Lors de la formation du nouveau composé, les quantités de limaille de fer et de fleur de soufre qui réagissent sont-elles en relation l'une avec l'autre? La quantité de fleur de soufre qui entre dans la composition du sulfure de fer dépend-elle de la quantité de limaille de fer disponible et inversement? Plus précisément, une quantité donnée de fleur de soufre réagit-elle toujours avec une même quantité de limaille de fer pour former une même quantité de sulfure de fer? Pour le déterminer nous allons, une fois encore, faire confiance à l'expérimentation.
Expérience 3
| Fer
Prélevons un peu de limaille de fer dans une cuiller à combustion. Chauffons énergiquement.
Nous obtenons une masse rouge. Après refroidissement, les propriétés caractéristiques initiales de la limaille de fer sont restées inchangées. |
Fer-soufre
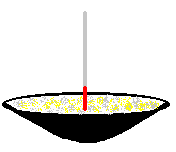
Versons un mélange de 10g de limaille de fer et de 4g de fleur de soufre dans un creuset. Introduisons une tige de fer portée au rouge.
Le mélange fer-soufre a changé d'aspect. Il reste dans le creuset de la poudre grise attirée par l'aimant. |
Sous l'action de la chaleur, le fer et le soufre ont formé du sulfure de fer, mais il subsiste un excès de fer dont les propriétés caractéristiques initiales sont restées inchangées.
|
Soufre Prélevons un peu de fleur de soufre dans une cuiller à combustion. Chauffons énergiquement.
Le soufre devient liquide, ensuite il brûle avec une flamme bleue. Une odeur piquante se dégage. |
Fer-soufre Versons un mélange de 7g de limaille de fer et de 8g de fleur de soufre dans un creuset. Introduisons une tige de fer portée au rouge.
Le mélange fer-soufre a changé d'aspect. Le phénomène s'est accompagné de l'apparition d'une flamme bleue. Une odeur piquante s'est dégagée. |
Sous l'action de la chaleur, le fer et le soufre ont formé du sulfure de fer, mais il existait un excès de soufre qui a brûlé en produisant une flamme bleue.
En fait, de multiples expériences menées sur des périodes de temps relativement longues ont permis d'établir que le fer et le soufre se transforment en sulfure de fer sous l'action de la chaleur en réagissant toujours dans des proportions fixes et définies qui sont de 7g de fer pour 4g de soufre.
Nous écrivons:
| Mélange | Réaction | Produit |
| Fer + Soufre | Sulfure de fer | |
| 7g + 4g | 11g |
Synthèse 2
Toutes les manipulations que nous avons réalisées depuis le début de ce cours peuvent être classées en deux catégories facilement distinctes:
![]() catégorie
1: les manipulations qui conservent aux constituants d'un mélange, ou à
une substance, leurs propriétés caractéristiques initiales;
catégorie
1: les manipulations qui conservent aux constituants d'un mélange, ou à
une substance, leurs propriétés caractéristiques initiales;
![]() catégorie
2: les manipulations qui conduisent à une transformation des constituants d'un mélange, ou d'une substance, avec pour conséquence la perte des
propriétés caractéristiques initiales de ceux-ci.
catégorie
2: les manipulations qui conduisent à une transformation des constituants d'un mélange, ou d'une substance, avec pour conséquence la perte des
propriétés caractéristiques initiales de ceux-ci.
Nous appellerons "phénomènes physiques" les manipulations de la catégorie 1.
Nous appellerons "phénomènes chimiques" les manipulations de la catégorie 2.
Ainsi, nous pouvons écrire:
| La
formation d'un mélange et les opérations de séparation de ses
constituants sont des:
Ils ont lieu entre:
|
La
transformation fer + soufre en sulfure de fer est un:
Il a lieu entre:
|
D'une manière générale, lors de phénomènes physiques la matière ne subit pas de transformations (le fer reste du fer, le soufre reste du soufre).
A l'inverse, lors de phénomènes chimiques la matière subit de profondes transformations (le fer et le soufre se transforment en sulfure de fer).
il est
|
Vous pouvez envoyer vos commentaires et suggestions:
pierre_hebrant@yahoo.fr |
Vous pouvez aussi m'écrire: Hebrant pierre Athénée Royal Bruxelles 2 - Rue de Molenbeek, 72-74 à 1020 Bruxelles.
|