1.4. Les limites de divisibilité de la matière
Nous savons maintenant avec certitude que la matière est divisible. Une autre question se pose alors à nous. Cette divisibilité est-elle infinie ou connaît-elle ses limites? Si limites il y a, quelles sont ces limites?
Encore une fois, l'expérimentation va venir à notre secours. Reprenons, par exemple, l'expérience de dilution de l'iode dans le tétrachlorure de carbone. Plus nous diluons l'iode dans le tétrachlorure de carbone, moins nous avons de particules d'iode dans notre éprouvette. Cela se traduit par une décoloration progressive de la solution.
Essayons de schématiser le phénomène. Pour fixer les idées, nous considérons au départ cent particules (grains) d'iode dans dix millilitres de tétrachlorure de carbone. Nous prélevons un millilitre de cette solution, donc dix particules d'iode, que nous introduisons dans neuf millilitres de tétrachlorure de carbone pur. Nous avons dix particules d'iode dans dix millilitres de solution. Nous prélevons un millilitre de cette dernière solution, donc une particule d'iode, que nous introduisons dans neuf millilitres de tétrachlorure de carbone pur. Nous avons une particule d'iode dans dix millilitres de solution. Cette particule ultime, élémentaire, d'iode n'est plus divisible. La divisibilité de la matière est donc limitée. Schématisons notre raisonnement:
|
diluer dix fois |
diluer dix fois |
|||
|
|
|
|
|
|
|
cent particules d'iode |
dix particules d'iode |
une particule d'iode |
Appelons "atome" d'iode une particule de l'élément iode que l'on peut isoler , par dilutions successives, à l'état dissous. Dans les cas les plus simples, une substance est composée de particules élémentaires appelées "atomes". Cependant, de nombreuses substances sont composées de particules élémentaires elles-mêmes composées d'associations d'atomes, ainsi:
- le sulfure de carbone, composé de soufre et de carbone;
- le tétrachlorure de carbone, composé de carbone et de chlore;
- le sulfure de fer, composé de soufre et de fer.
De telles associations d'atomes s'appellent des "molécules". Les particules élémentaires qui constituent une substance peuvent être soit des atomes soit des molécules, cela dépend de la substance considérée.
Nous pouvons maintenant introduire de nouvelles notions.
Nous appellerons "corps simple" une substance composée d'atomes semblables, de même nature, ou une substance composée de molécules semblables, de même nature, molécules elles-mêmes composées d'atomes semblables, de même nature.
Nous appellerons "corps composé" une substance composée de molécules semblables, de même nature, elles-mêmes composées d'atomes dissemblables, de natures différentes.
Nous appellerons "substance pure" ou "corps pur" une substance formée uniquement d'atomes ou de molécules de même nature.
Nous avons déjà rencontré divers "corps purs simples": le fer, le soufre, l'iode, le cuivre...
Nous avons aussi déjà rencontré divers "corps purs composés": le tétrachlorure de carbone, l'acide chlorhydrique, l'acide nitrique, le sulfure de fer...
Il convient de préciser que de nombreux corps purs simples ne sont pas de vulgaires empilements d'atomes. Au contraire, ces atomes montrent fréquemment une disposition géométrique qui leur est propre. Un nombre défini d'atomes se regroupent et forment ce que l'on appelle un cristal. Le fer est constitué d'atomes de fer regroupés par neuf au sein d'un cristal dont la disposition géométrique est un cube centré (un atome occupe le centre du cube).
Cristal de pyrite:
|
|
Cristal de soufre:
|
|
Cristal de magnétite:
|
|
La force de cohésion qui maintient la stabilité d'un tel cristal se nomme l'affinité atomique.
Le soufre montre un cristal formé de huit atomes. La disposition géométrique au sein du cristal est de la plus haute importance. Le carbone, exemple le plus célèbre, se nomme diamant ou graphite (mine de crayon noir) selon la disposition géométrique qu'il adopte.
Nous est-il possible d'exploiter les notions que nous venons d'étudier afin de proposer un modèle de constitution de la matière tenant compte de ses états physiques? Nous connaissons les trois états de la matière: solide, liquide et gazeux. Nous savons qu'une même substance peut présenter successivement un de ces trois états: il faut lui fournir de l'énergie calorifique - on la chauffe ou on la refroidit - pour la faire passer d'un état à un autre. Concernant trois substances qui nous sont connues, nous pouvons écrire:
|
Constantes physiques Fer
|
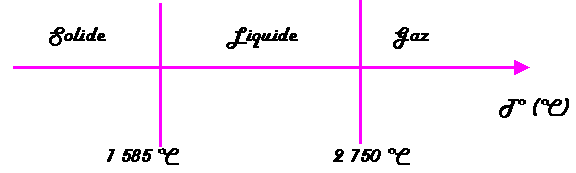
États physiques Fer
|
|
Constantes physiques Soufre
|
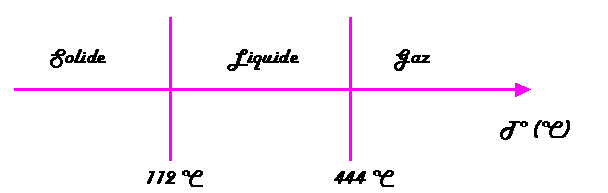
États physiques Soufre
|
|
Constantes physiques Eau
|
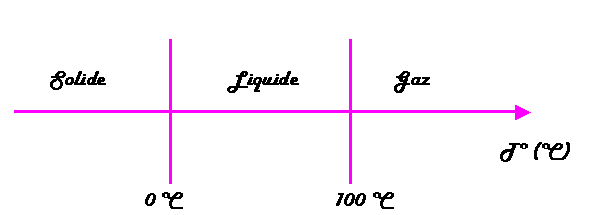
États physiques Eau
|
La fusion et l'ébullition, comme la dilution, sont des phénomènes physiques. Ils permettent la dispersion des atomes ou molécules.
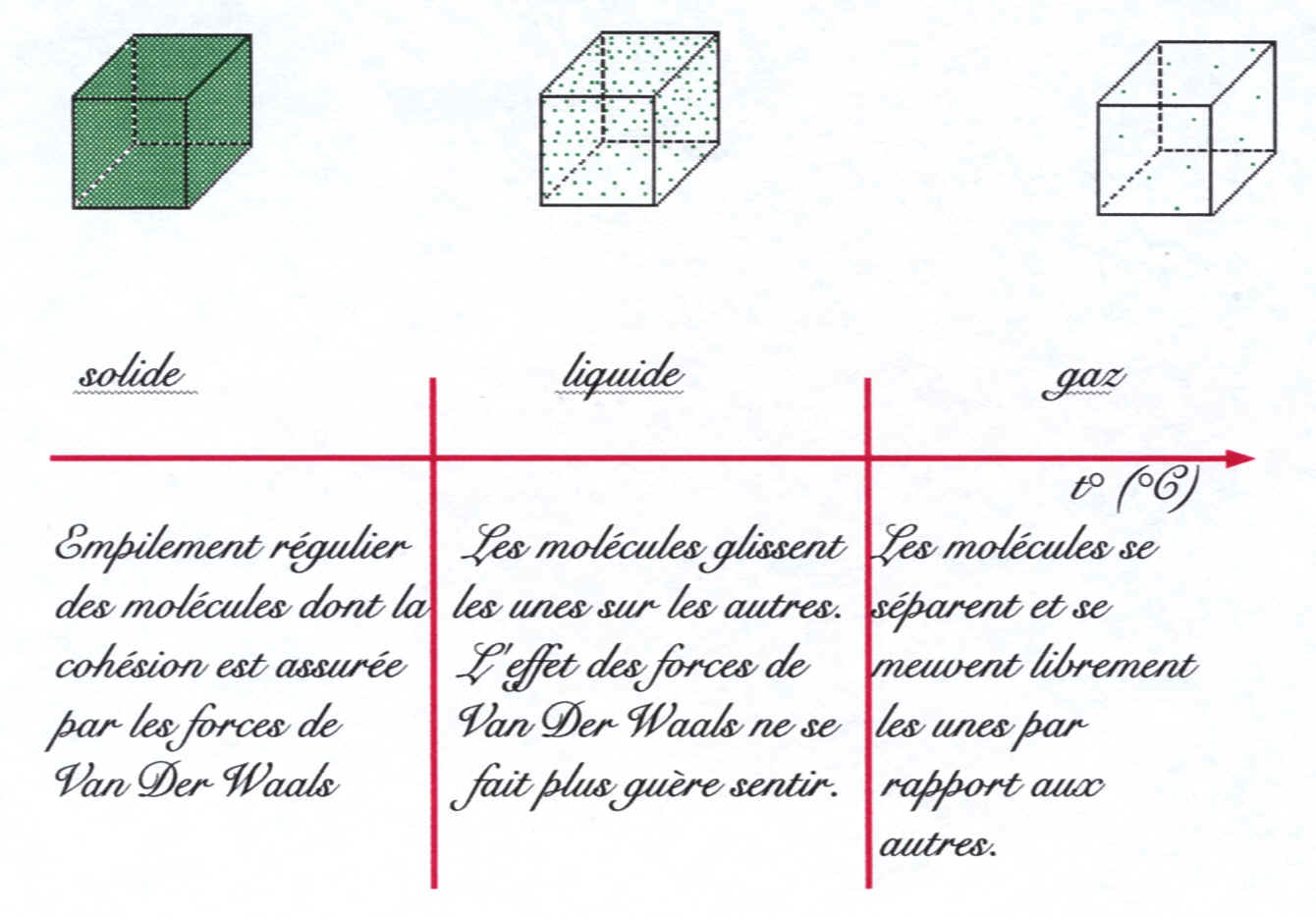
Essayons de schématiser la structure moléculaire de la matière en fonction de son état physique, et donc de sa température. Pour cela, nous allons considérer un volume constant de matière que nous allons progressivement chauffer. Lorsque nous chauffons la matière, nous lui apportons de l'énergie calorifique que les molécules (atomes) utilisent pour rompre la cohésion moléculaire (atomique) qui assure l'état solide. Cette cohésion moléculaire (atomique) est due à l'existence de forces d'attraction entre molécules (atomes) dites forces de Van Der Waals.
Si nous apportons suffisamment d'énergie calorifique, les forces de Van Der Waals ne sont plus suffisamment intenses pour assurer la stabilité de l'édifice moléculaire (atomique). Les molécules (atomes) glissent les unes sur les autres: c'est l'état liquide. Si nous continuons à apporter de l'énergie calorifique en supplément, viendra le moment où la quantité d'énergie calorifique sera telle que les molécules (atomes) rompront leurs attaches et se sépareront les unes des autres: c'est l'état gazeux.
|
|
Une augmentation de la quantité de chaleur (par apport d'énergie calorifique) favorise l'agitation des molécules (atomes) jusqu'à leur séparation complète à l'état gazeux. L'augmentation de l'agitation moléculaire (atomique) se traduit par une élévation de la température. La température donne une indication de l'intensité de l'agitation moléculaire (atomique). Un solide peut être le siège d'une agitation moléculaire (atomique) intense, la température repérée est alors élevée. A l'inverse un gaz peut montrer une faible agitation moléculaire (atomique) - pensons à l'air qui nous entoure -, la température repérée est alors modérée. Comment expliquer que, à une température donnée (par exemple 20 °C), certaines substances sont liquides, d'autres solides, d'autres encore gazeuses? Rappelons-nous: la cohésion moléculaire (atomique) est assurée par les forces de Van Der Waals. Or l'intensité des forces de Van Der Waals dépend de la nature des molécules (atomes), donc de la substance, et en sont une caractéristique physique. Une substance au sein de laquelle l'intensité des forces de Van Der Waals est faible est gazeuse à 20 °C. Une substance au sein de laquelle l'intensité des forces de Van Der Waals est grande est solide à 20 °C. Une substance au sein de laquelle l'intensité des forces de Van Der Waals est médiocre est liquide à 20 °C. Ce phénomène explique que la température de fusion ou d'ébullition est une caractéristique propre et constante d'un corps pur. Par exemple, la température de fusion de l'eau est de 0 °C alors que celle du platine est de 1775 °C. Cela signifie simplement que l'intensité des forces de Van Der Waals est bien plus grande au sein du platine qu'au sein de l'eau.
Synthèse 4
La matière est divisible, mais cette divisibilité connaît ses limites. Pour une substance donnée, un corps pur donné, la plus petite particule que l'on puisse concevoir sans détruire ce corps pur se nomme l'atome ou la molécule.
Un corps pur composé est toujours constitué de molécules semblables, de même nature, qui sont dans ce cas des assemblages d'atomes dissemblables, de natures différents.
Un corps pur simple est composé d'atomes identiques, de même nature, qui souvent s'associent entre eux pour former des cristaux ou des molécules.
La matière existe sous trois états physiques distincts: solide, liquide et gazeux. Dans un solide, les molécules (atomes) du corps pur sont serrées, rangées régulièrement et s'attirent très fortement entre elles (grande intensité des forces de Van Der Waals). Dans un liquide, les molécules (atomes) du corps pur sont moins serrées, peuvent glisser librement les unes sur les autres et s'attirent modérément entre elles (médiocre intensité des forces de Van Der Waals). Dans un gaz, les molécules (atomes) du corps pur sont à distance les unes des autres, se meuvent librement et ne s'attirent pas entre elles ou très faiblement (très petite intensité des forces de Van Der Waals).
La température d'un corps n'est pas une grandeur physique mesurable, mais traduit l'intensité de l'agitation moléculaire (atomique) au sein de ce corps. On ne mesure pas la température, on la repère.
il est

|

|
|
Vous pouvez envoyer vos commentaires et suggestions:
pierre_hebrant@yahoo.fr |
Vous pouvez aussi m'écrire: Hebrant pierre Athénée Royal Bruxelles 2 - Rue de Molenbeek, 72-74 à 1020 Bruxelles.
|