1.9.L'électrolyse de l'eau
Avant de procéder à l'expérience d'électrolyse de l'eau, nous devons prendre connaissance de l'hypothèse d'Avogadro - Ampère concernant les gaz. Cette hypothèse sera regardée par nous comme un axiome, c'est-à-dire une proposition évidente par elle-même et qui n'est susceptible d'aucune démonstration.
L'hypothèse d'Avogadro - Ampère affirme que: "des volumes égaux de tous les gaz, dans les mêmes conditions de température et de pression, contiennent le même nombre de molécules". Ainsi, 1 litre d'oxygène contient le même nombre de molécules que 1 litre d'hydrogène ou que 1 litre de n'importe quel gaz, dans la mesure où ces volumes sont déterminés dans les mêmes conditions.
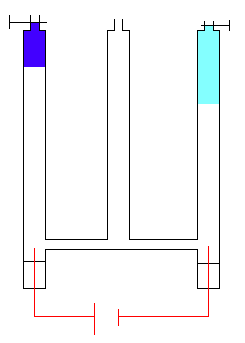
Nous constatons que le passage du courant électrique provoque un dégagement gazeux tant à l'anode (électrode positive) qu'à la cathode (électrode négative). Le volume de gaz qui se dégage à la cathode est double du volume de gaz qui se dégage à l'anode.
Prélevons dans une éprouvette un échantillon du gaz qui se dégage à l'anode. Un tison rougeoyant se rallume (flamme vive). Le gaz recueilli à l'anode est un comburant: c'est le dioxygène.
Prélevons dans une éprouvette un échantillon du gaz qui se dégage à la cathode. Approchons une flamme. Le gaz explose en provoquant un aboiement caractéristique: c'est le dihydrogène.
Lors de l'électrolyse de l'eau deux gaz se dégagent, l'un à l'anode c'est le dioxygène, l'autre à la cathode c'est le dihydrogène. Si nous observons les volumes de gaz dégagés, nous constatons qu'il se forme deux volumes de dihydrogène pour un volume de dioxygène. Rappelons-nous ce que nous dit l'hypothèse d'Avogadro - Ampère: "à la même température et sous la même pression, des volumes égaux de gaz différents contiennent toujours le même nombre de molécules". Par conséquent, le volume de dihydrogène étant double du volume de dioxygène, la dissociation de l'eau fournit deux fois plus de molécules de dihydrogène que de molécules de dioxygène. Pour deux molécules de dihydrogène dégagées, nous aurons une molécule de dioxygène dégagée.
Nous devons poser plusieurs hypothèses relatives à la composition de l'eau et déterminer quel modèle moléculaire s'accorde avec les résultats de notre expérience. Recherchons le modèle de la molécule d'eau. Soit les modèles suivants:
sachant que l'oxygène peut se lier à deux autres atomes et l'hydrogène à un seul, nous pouvons imaginer deux modèles de molécules d'eau:
|
|
|
![]() Première hypothèse
Première hypothèse
|
|
|
|
+ |
|
Deux molécules d'eau se dissocient en deux molécules de dihydrogène et une molécule de dioxygène.
![]() Seconde hypothèse
Seconde hypothèse
|
|
|
|
+ |
|
L'hypothèse d'Avogadro - Ampère nous conduit à rejeter ce modèle moléculaire car si la dissociation de l'eau produisait autant de molécules de dihydrogène que de molécules de dioxygène, les volumes de gaz dégagés seraient égaux. Or l'expérience nous montre que le volume de dihydrogène dégagé est le double du volume de dioxygène dégagé. La première hypothèse est donc la bonne.
1.9.1. L'eau - Généralités
Lorsque l'eau est un corps pur composé, elle s'appelle eau distillée ou eau déminéralisée. L'eau distillée ne conduit pas le courant, mais elle est rendue conductrice par l'addition d'un peu d'acide et est dissociée par le passage du courant électrique dans des proportions précises en deux gaz.
Le dioxygène recueilli à l'anode (électrode positive) est un comburant. Le dihydrogène recueilli à la cathode (électrode négative) est un combustible. L'association des deux gaz dans des proportions précises forme de l'eau en présence d'une flamme ou d'une étincelle électrique. L'eau est le résultat d'une combinaison.
Les eaux naturelles (eaux minérales, eau de la conduite) sont des mélanges homogènes d'eau et d'autres substances dissoutes dans l'eau et qui rendent les eaux naturelles conductrices de l'électricité. Les eaux naturelles ne sont donc pas pour le chimiste des corps purs. Les eaux naturelles diffèrent entre elles en ce qu'elles contiennent une plus ou moins grande variété de substances différentes dissoutes et en quantités variables. C'est ce qui explique que les goûts varient. La composition chimique des eaux naturelles figure sur l'étiquette de la bouteille.
Synthèse 8
Le corps pur composé eau est formé de molécules identiques entre elles qui sont constituées de deux atomes d'hydrogène associés à un atome d'oxygène. L'eau pure (distillée ou déminéralisée) n'est pas conductrice de l'électricité. Elle est rendue conductrice par l'addition d'un peu d'acide et est alors dissociée par le passage d'un courant électrique continu (électrolyse), dans des proportions précises, en deux gaz:
![]() 1 volume de dioxygène
recueilli à l'anode; le dioxygène est un comburant;
1 volume de dioxygène
recueilli à l'anode; le dioxygène est un comburant;
![]() 2 volumes de dihydrogène
recueillis à la cathode; le dihydrogène est un combustible.
2 volumes de dihydrogène
recueillis à la cathode; le dihydrogène est un combustible.
Ces deux gaz se combinent dans des proportions précises en présence d'une flamme ou d'une étincelle électrique pour former de l'eau. L'eau est le résultat d'une combinaison.
Les eaux naturelles, minérales, sont des mélanges homogènes d'eau et d'autres substances dissoutes dans l'eau. Ces substances rendent les eaux conductrices et sont responsables de leurs qualités gustatives.
il est

|

|
|
Vous pouvez envoyer vos commentaires et suggestions:
pierre_hebrant@yahoo.fr |
Vous pouvez aussi m'écrire: Hebrant pierre Athénée Royal Bruxelles 2 - Rue de Molenbeek, 72-74 à 1020 Bruxelles.
|





