1.8.La composition de l'air
Nous savons maintenant ce que signifient les termes: atome, molécule, corps pur simple, corps pur composé, mélange homogène, mélange hétérogène, phénomène physique, phénomène chimique, combinaison.
Par le biais de réactions d'association, nous avons étudié deux lois importantes: la loi de Lavoisier et la loi de Proust.
Nous sommes maintenant bien armés pour pousser plus avant nos investigations, et nous demander de quoi est composé le milieu au sein duquel nous vivons: l'air.
Comment serait-il possible d'analyser l'air, de mettre en évidence ses constituants? Bien sûr, il nous faut d'abord isoler un petit volume de l'air qui nous entoure, puis procéder à des expérimentations.
Nous disposons d'une cloche de verre dont la partie supérieure ferme hermétiquement grâce à un bouchon. Il nous faut avant tout connaître, et donc mesurer, le volume de cette cloche de verre. A cette fin, nous la remplissons d'eau - la cloche est obturée à son extrémité supérieure bien entendu - puis versons cette eau dans une éprouvette graduée. Nous connaissons le volume de la cloche. Divisons ce volume en dix parties égales tracées sur la cloche grâce à un marqueur résistant à l'eau.
Dans un bac de verre rempli aux 2/3 d'eau, renversons notre cloche de manière à emprisonner un morceau de phosphore rouge sur son support de porcelaine.
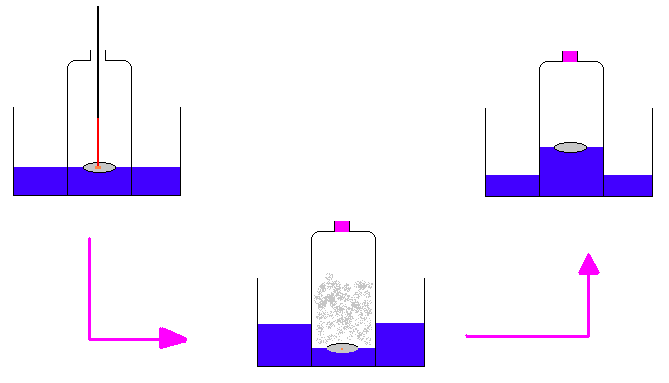
Le phosphore brûle et il se forme une fumée blanche opaque. Simultanément, le niveau de l'eau baisse dans la cloche de verre. La fumée blanche disparaît peu à peu, l'eau se trouble et le niveau remonte. A l'équilibre, l'eau atteint la deuxième graduation (2/10 du volume d'air présents sous la cloche avant la combustion du phosphore ont été remplacés par de l'eau). A la fin de la réaction, il reste un peu de phosphore non utilisé. Une bougie allumée s'éteint dans le gaz contenu sous la cloche de verre.
.Nous venons d'assister à la combustion vive du phosphore dans l'air. La quantité de chaleur dégagée à cette occasion dilate les gaz (agitation moléculaire plus importante) sous la cloche, gaz qui repoussent l'eau. La fumée se dissous dans l'eau. La combustion vive du phosphore consomme 1/5 du volume gazeux contenu sous la cloche.
Le phosphore est un corps pur simple tétratomique (le cristal est un tétraèdre formé de quatre atomes de phosphore). Le gaz disparu est un corps pur simple diatomique, le dioxygène. il représente 20% du volume de l'air. Les 80% restants sont constitués surtout par un autre corps pur simple diatomique, le diazote. Dès qu'il n'y a plus de dioxygène sous la cloche, le phosphore ne brûle plus. Nous dirons donc:
![]() Le gaz dioxygène permet au phosphore de
brûler, le dioxygène est un comburant;
Le gaz dioxygène permet au phosphore de
brûler, le dioxygène est un comburant;
![]() Le
phosphore brûle dans le dioxygène, le phosphore est un combustible.
Le
phosphore brûle dans le dioxygène, le phosphore est un combustible.
il est

|

|
|
Vous pouvez envoyer vos commentaires et suggestions:
pierre_hebrant@yahoo.fr |
Vous pouvez aussi m'écrire: Hebrant pierre Athénée Royal Bruxelles 2 - Rue de Molenbeek, 72-74 à 1020 Bruxelles.
|


